|
01.01.15
Конкурс РФФИ 2015 года
Российский фонд фундаментальных исследований (РФФИ) проводит конкурс проектов участия российских ученых в научных мероприятиях, проводимых за рубежом 2012 года. Заявки принимаются до 01.11.2015 Внимание Вышла в продажу вторая редакция книги "Twenty-First Century. General Chemistry" |
Home / Учебник ОБЩАЯ ХИМИЯ / Глава 4. Химическая связь / Изомеризация. Динамическая связь / Изомеризация ИзомеризацияИзмеризация - результат электронных переходов от одной связи к другой в пределах молекулы. Можно привести следующие примеры: Таутомерное превращение:
Электронная изомеризация бульвалена Электронная изомеризация гомотропомидена (Homotropimedene)
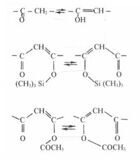
Электронно-ядерная изомеризация гидроцианистой кислоты: HC ≡ N ⇄ H─N = C Из химических опытов мы знаем об электронно-ядерной изомеризации, которая происходит в соединениях типа бульвалена и гомотропомидена. Согласно формуле, бензол напоминает соединения бульвалена, поэтому в бензоле должна происходить электронно-ядерная изомеризации, и наблюдаться взаимные переходы форм бензола. Аномальная величина энергии и длины связей в бензоле (когда энергия и длина связей равны) связаны с явлением электронно-ядерной изомеризации. Взаимный переход происходит на такой большой скорости, что современная техника пока не может ее определить. Пример с бензолом показывает, что с увеличением скорости электронно-ядерной изомеризации, все эффекты, связанные с этой скоростью увеличиваются. Эти эффекты включают в себя снижение энергии связи, уменьшение количества слабых связей, а также общее снижение энергии системы. Скорость электронно-ядерной изомеризации зависит от скорости перехода ядер. Так, в случае бензола и водородной связи, эти эффекты наиболее очевидны. При образовании Н-связи, скорость перехода электрона значительно выше, чем скорость перехода в других связях. В бензоле во время процесса изомеризации атомы проходят более короткие расстояния. Изомеризация ацетилацетона подтверждает возможность электронно-ядерной изомеризации в системах, где ковалентные связи и ВВС образуются одновременно. Вот пример с три-метил-аллюминием:
Здесь мы видим, что и система только с единичными связями также постоянно перегруппировывается. Это явление характерно для химических соединений и не ограничивается какими-либо определенными атомами или связями. Во всех случаях электронные переходы проявляются в выравнивании длины и энергии связей и в увеличении энергии слабых связей (т.е. повышение устойчивости), поэтому не удивительна устойчивость изомеров. Вышеупомянутое объяснение считается феноменологическим и поднимает новые вопросы: Какова же физическая природа явления, называемого электронно-ядерной изомеризацией? За счет какой энергии электрон переходит от одного минимума к другому? Затруднение с ответом на последний вопрос было вызвано одним из основных принципов квантовой механики, который предполагает, что электрон не может изменить свою энергию менее чем на 10 эВ. Традиционно, обмен энергией между электронами никогда не предполагался в квантовой химии, а в рамках G- теории обмен энергией между электронами обосновывается. Электронная энергия молекул зависит от энергии ядер. Закон Максвелла-Больцмана описывает распределение колебательной, вращательной и поступательной энергии ядер. Соответственно, мы можем предположить, что этот закон описывает также и распределение энергии электронов. Атомные системы (электроны и ядра) содержат в себе как механизм поступательного движения, так и механизм изменения колебательной энергии. Если в механизме поступательного движения энергия переходит от частиц с большей энергией к частицам с меньшей энергией, то в случае с колебательным движением, переход энергии зависит от фазы колебаний, а не от величины энергии. Давайте вспомним обмен энергией между маятниками, колеблющимися на одной оси. Оба механизма позволяют предположить накопление достаточного количества энергии электроном, чтобы последний смог преодолеть барьер, разделяющий минимумы, так как средняя энергия внешних электронов в системе равна 12 эВ. Оценим энергию барьера, который должны преодолеть электроны. Согласно G-теории химической связи, выигрыш в энергии при образовании связи вызван c приближением ядер к связывающим электронам, расположенным между ними. В гипотетической системе D ... H : T, переход электронов от ковалентной связи (H : T) к ВВС (D ... H) с образованием D : H ... T, связан с удалением электрона от атома T и приближением к атому H. Таким образом, верхний предел барьера, при переходе одного электрона от связи Н : T на атом H, составляет половину выигрыша в энергии (энтальпии) при образовании связи и равен 1 эВ. Удаление от одного ядра атома T с одновременным приближением к ядру атома H существенно не меняет общую потенциальную энергию системы и, следовательно, высота барьера существенно ниже, чем 1 эВ (близка к нулю). Однако, если мы считаем, что электрон удаляется от атома T и приближается к двум атомам D ... H во время перехода, то высота барьера равна 0 - 0,2 эВ, то есть больше, чем барьер, который могут преодолеть электроны со средней энергией в 12 эВ. Кинетическая энергия электрона в атоме составляет около 10 эВ. Следующее уравнение для кинетической энергии E = mv2 / 2, помогает определить скорость электронов: v = (2E / m)0.5 = (2 · 10 · 96 · 103 / 9.1 · 10-31 · 6.02 · 1023)0.5 ~106 m/ sec = 1016Å / sec. Эту скорость можно сравнить со скоростью перехода электрона, измеренной экспериментальным путем и рассчитанной следующим образом: v = 1017 e-2R/L где R - это расстояние Å (в нашем случае 1Å); а L - коэффициент, равный 6,5 в сопряжённых системах, и 0,7 ─в несопряженных. В соответствии с этой формулой, скорость перехода электронов для сопряженных систем можно оценить в 1017 Å/сек, а для несопряженных ~1016 Å/сек, т. е., значения близки к тем, что уже были вычислены. Данное объяснение и значения, полученные по результатам эксперимента, полуколичественно совпадают. Как упоминалось выше, колебательная система может иметь и другой механизм, имитирующий переход электронов. В этом случае переход не осуществляется, а происходит передача энергии от одного электрона другому, вращающемуся, например, в параллельном круге. В результате такого обмена, связь, которая до сих пор была ковалентной, например, в системе D ... H : H, становится ВВС и наоборот - система становится D : H ... H. Время этих переходов можно определить по частоте вращения электрона, которая составляет около 10-16 сек. Возможно одновременное существование обоих механизмов. Механизм, характерный для поступательного движения, должен привести ядра в равновесное состояние. Система находится в динамическом равновесии, определенном законами термодинамики, то есть, скорость взаимных переходов определяется по изменению свободной энергии. Для колебательного механизма характерно, что система переходит из одного состояния в другое с одинаковой скоростью, независимо от изменения свободной энергии. Действительно, в соответствии с экспериментом, наблюдались случаи, когда скорость перехода зависела от изменения свободной энергии, но также наблюдались случаи, когда это не происходило. Почему же в результате электронно-ядерной изомеризации связи становятся короче? Скорость перехода электронов примерно на 2 порядка выше, чем ядер. По этой причине ядра занимают промежуточное положение, что приводит к укорачиванию слабой связи. Укорачивание и укрепление слабых связей в результате электронно-ядерной изомеризации позволяет объяснить повышенную термическую стабильность ароматических соединений, определяемой по слабой связи. Кроме того, увеличение электронной энтропии обусловлено повышением устойчивости ароматических соединений, которая в свою очередь связана с электронно-ядерной изомеризацией. Так как, ароматические соединения состоят из различных изомеров, это приводит к увеличению количества возможных микросостояний электронов для этих систем и, следовательно, к увеличению электронной энтропии и увеличению термической стабильности системы. |