|
01.01.15
Конкурс РФФИ 2015 года
Российский фонд фундаментальных исследований (РФФИ) проводит конкурс проектов участия российских ученых в научных мероприятиях, проводимых за рубежом 2012 года. Заявки принимаются до 01.11.2015 Внимание Вышла в продажу вторая редакция книги "Twenty-First Century. General Chemistry" |
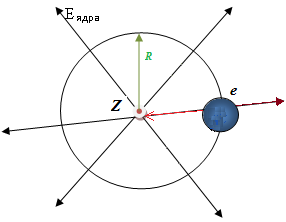
Home / Учебник ОБЩАЯ ХИМИЯ / Глава 2. Атомная Структура / Модель атома водорода Модель атома водородаСамым простым химическим элементом с точки зрения строения атома является водород. Его ядро содержит всего лишь один протон, вокруг которого вращается один электрон. Такая модель атома водорода получила название модель Бора (см. рис.1). Электрон притягивается к ядру за счет электростатических сил взаимодействия. Однако электрон не падает на ядро, поскольку вращается вокруг него на большой скорости. На вращающийся электрон действует центробежная сила. Центростремительная (электростатическая) сила Fцс, связывающая заряженные частицы, и центробежная сила Fцб, стремящаяся оторвать электрон от ядра, на определенном расстоянии между заряженными частицами уравновешивают друг друга. Fцс = Fцб. (2.1) Это уравнение выражает условие устойчивости орбиты электрона в атоме.
Зато можно измерить энергию ионизации или потенциал ионизации (ПИ) - минимальную энергию, что необходима для отрыва электрона от ядра атома. Так, если поместить атомы водорода в электростатическое поле и сообщить им количество энергии, необходимое для отрыва электрона от ядра, то в системе возникнет направленное движение электронов, т.е. электрический ток, который зафиксируется приборами. Поскольку все атомы, кроме атома водорода, имеют более одного электрона, то различают первый, второй и т.д. потенциалы ионизации. Ясно, что второй потенциал ионизации для одного и того же атома будет несравненно больше первого, так как электрон приходится отрывать от положительно заряженного иона. Таким образом, первый потенциал ионизации (ППИ) действительно соответствует минимальной энергии. Потенциальная энергия электрона Е в атоме водорода, согласно теореме вириала равна удвоенному потенциалу ионизации: Е = 2ППИ (2.3) Измеренное значение для атомов водорода Е = 2·1311,6 ≈ 2623 кДж/моль, или в расчете на один атом Е = 2623: (6,02 ·1023)= 435 ·10 -23 кДж/моль Зная потенциал ионизации, и используя формулу для электростатической энергии электрона, находящегося на расстоянии R от протона
мы получаем выражение для расчета орбиты электрона в атоме:
где ε0= 8,85·10 -12 Ф/м - электрическая постоянная; 103 - переход от кДж к Дж; заряд в квадрате, так как протон и электрон имеют одинаковые абсолютные значения заряда. В наших расчетах мы не прибегали ни к каким предположениям относительно особых свойств электрона, а исходили исключительно из уравнений, описывающих энергетические взаимодействия в системе. Размер атомного ядра составляет примерно 10-4нм. Представить себе соотношение размеров ядра и атома можно, если предположить, что ядро имеет размер шарика для пинг-понга (примерно 5 см в диаметре), тогда атом будет иметь размеры, близкие к размерам стадиона в Лужниках. Теперь давайте посмотрим, какова зависимость между зарядом ядра и энергией системы для водородоподобных атомов (имеющих только один электрон), найденная экспериментально и теоретически (расчетным путем). Эти данные приведены в табл. 1. Таблица 1. Энергия ионизации водородоподобных атомов
Экспериментально найденная зависимость энергии ионизации атома от заряда ядра хорошо описывается уравнением: Ez =EHZ2 (2.6) где Ez - энергия ионизации водородоподобного атома с зарядом ядра Z; Ен - энергия ионизации атома водорода. Как следует из данных табл. 1, расхождение между расчетным и найденным экспериментально значениями энергии ионизации, не превышает 0,1%. Таким образом, энергия ионизации водородоподобных атомов пропорциональна квадрату заряда ядра. Из теоремы вириала следует, что энергия системы пропорциональна произведению зарядов ядра и электрона, а в соответствии с уравнением (2.6) мы можем записать, что Ez=Ze/2R (2.7) т.е. энергия системы пропорциональна заряду ядра атома в первой степени. Поскольку речь идет об одной и той же энергии системы, то из кажущего несоответствия - пропорциональности энергии квадрату заряда ядра (эксперимент; уравнение (2.6)) и первой степени этого же заряда (терема вириала; уравнение (2.7)) - можно сделать вывод, что при увеличении заряда ядра пропорционально уменьшается радиус атома. Теорема вириала была выведена из предположения о том, что в атоме действуют только известные механические (центробежная) и электростатическая силы. Тот факт, что энергия атома зависит только от взаимодействующих зарядов (от заряда ядра, в частности), свидетельствует о том, что в атоме действительно действуют только электрические, кулоновские силы. Квадратичная зависимость очевидна. Известно, что энергия притяжения (потенциальная энергия) между двумя зарядами пропорциональна произведению этих зарядов (или квадрату заряда в случае их идентичности) и обратно пропорциональна расстоянию между ними. В атомных системах при увеличении заряда ядра расстояния между ядрами и электронами пропорционально уменьшаются. Такая зависимость приводит к непропорциональному увеличению потенциальной энергии при увеличении заряда ядра. Первая энергия ионизации атомов >> Экспериментальные данные по энергии ионизации >> |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||