|
01.01.15
Конкурс РФФИ 2015 года
Российский фонд фундаментальных исследований (РФФИ) проводит конкурс проектов участия российских ученых в научных мероприятиях, проводимых за рубежом 2012 года. Заявки принимаются до 01.11.2015 Внимание Вышла в продажу вторая редакция книги "Twenty-First Century. General Chemistry" |
Home / Учебник ОБЩАЯ ХИМИЯ / Глава 4. Химическая связь / Энергия химической связи Энергия химической связи
С точки зрения выигрыша в энергии, образование связи - это нечто вроде промежуточного процесса между присоединением электрона к нейтральному атому (измеренное сродство к электрону) и присоединением электрона к атому, заряд ядра которого увеличивается на 1 единицу. Чтобы оценить энергию химической связи молекул, состоящих из многоэлектронных атомов, необходимо оценить:
Соотношение между энергией ионизации и зарядом ядра можно выразить следующим образом (см. раздел о энергии химической связи в атоме водорода): EionZ = EionH Z2 , (4.3-1) где EionZ и EionH - это энергия ионизации у водородоподобного атома и у атома с зарядом Z. В случае с многоэлектронными атомами, значения зарядов ядер, используемые при вычислениях, не являются действительными зарядами ядер этих атомов. В таких вычислениях следует использовать так называемые эффективные заряды ядер (положительные заряды, которые действуют на связывающую электронную пару). Аналогично уравнению (4.3-1), значение энергии межъядерного отталкивания, необходимое для оценки энергии молекулы, может быть также оценено с использованием эффективного заряда ядра с помощью выражения: Erep eff = ErepH2 Zeff1 · Zeff2, (4.3-2) где Erep eff - это эффективная энергия межъядерного отталкивания в молекуле, состоящей из двух атомов; ErepH2 - энергия отталкивания у молекулы H2; Zeff1 и Zeff2 - эффективные заряды ядер первого и второго атомов с учетом межядерного отталкивания. Мы рассчитали энергию химической связи двухатомных молекул, состоящих из атомов и нескольких электронов как одноэлектронных атомов или водородоподобных атомов с зарядом ядра, равным эффективному заряду ядра этих молекул. Для определения изменения электронной энергии при образовании молекулы из однотипных атомов, также как в случае с молекулой водорода, мы вычитаем энергию двух атомов от энергии молекулы и получаем, что эта энергия равна энергии связи в молекуле. Рассмотрим раскладку сил в молекуле >> Теперь мы можем вернуться объяснению энергии связи для группы D таблицы 4.4. >>
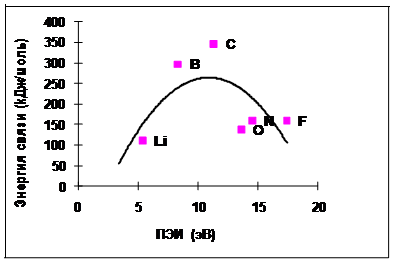
Рис. 4.3-2 Экспериментальные данные по зависимости энергии химической связи в молекуле Х-Х от ПЭИ атома Х для элементов второго периода На рис. 4.3-2 и 4.3-3 показана зависимость энергии химической связи от ПЭИ атомов, составляющих эти молекулы.
Рис.4.3-3 Зависимость энергии химической связи в молекуле Х-Х от ПЭИ атома Х для элементов третьего периода (расчетные данные и экспериментальные). Предполагалось, что энергия химической связи и ПЭИ (обе определяемые электростатическим взаимодействием) коррелируют между собой. Однако, расчетная зависимость энергии имеет форму Согласно экспериментальным данным, энергия связи атомов также увеличивается на интервале с 5 до 11 эВ, но при дальнейшем увеличении ПЭИ от 11 до 16 падает до 0. Очередное совпадение экспериментальной и расчетной зависимостей говорит о корректности объяснений природы химической связи. Принципы образования связи в многоэлектронных атомах >> Потенциал ионизации и энергия связи в двухатомных молекулах >> Энергия химической связи Длина связи >> |

 Присоединение электрона к атому происходит, когда имеется выигрыш в энергии, или, другими словами, если абсолютное значение потенциальной энергии системы атом + электрон возрастает в результате связи электрона с атомом.
Присоединение электрона к атому происходит, когда имеется выигрыш в энергии, или, другими словами, если абсолютное значение потенциальной энергии системы атом + электрон возрастает в результате связи электрона с атомом.