|
01.01.15
Конкурс РФФИ 2015 года
Российский фонд фундаментальных исследований (РФФИ) проводит конкурс проектов участия российских ученых в научных мероприятиях, проводимых за рубежом 2012 года. Заявки принимаются до 01.11.2015 Внимание Вышла в продажу вторая редакция книги "Twenty-First Century. General Chemistry" |
Home / Публикации / Книга "Как образуется химическая связь и протекают химические реакции" / 1.5. Количественная оценка энергии химической связи 1.5. Количественная оценка энергии химической связиПри построении модели будем исходить из того, что энергия связи - это энергия, которую нужно затратить на разрыв этой связи. Таким образом, если в начале процесса имеется молекула, а в его конце - атомы, то затрачиваемая на осуществление этого процесса энергия должна, по крайней мере, равняться разнице между энергиями электронов в молекуле и в атомах, составляющих эту молекулу. В молекуле наступает равновесие, когда силы притяжения между разноименно заряженными частицами уравновешиваются силами отталкивания между частицами с одноименным зарядом. Соотношение этих сил изображено на рис 3. Рис. 3. Схема сил, действующих в молекуле водорода
Силы F5 и F6 представляют собой проекцию сил притяжения электрона С ядрами A (F1) и В (F2) на ось, соединяющую ядра атомов. Сила отталкивания между ядрами, заряд которых eNi (i = 1, 2), в соответствии с законом Кулона и описывается уравнением: e2 N1N2/(x1+x2)2 (15) где х1 и х2 - соответственно отрезки АД и ВД, см. рис.3 Сила притяжения электрона ядрами в точке d равна сумме сил F7 и F8,. которые представляют собой проекцию сил притяжения электрона С ядрами А (F3) и В (F4) на высоту CD треугольника сил. Таким образом, можно записать: F9 = F7 + F8 - Fe (16) где Fe- сумма проекций сил отталкивания электрона от других электронов (на рис. 3 не показаны); оценка Fe будет дана позже. Показанные на рис. 3 силы могут быть рассчитаны с помощью следующих уравнений: F7 = F4cos∠ DCB = F4 a/(a2 + x22)0,5 = e2N2a/[(a2 + x22)]3/2 (17) F8= e2N1a/[(a2 + x21)]3/2 , F4= e2N2/(a2 + x22)2 (18) F9 = e2N1a/[(a2 + x21)]3/2 + e2N2a/[(a2 + x22)] 3/2 - Fe = = (e2/a2){[N1((x1/a)2 + l)-3/2 + N2((x2/a)2+l)-3/2 ] - (a2/e2) Fe } (19) где а - отрезок СД на рис.3 Введя обозначения F9 = (e2/a2)F0 и Fe= (e2/a2)Sn, получаем: F0 = [N1((x1/a)2 + l )-3/2 + N2((x2/a)2 + l )-3/2 ] - Sn (20) В соответствии с законом Кулона F9 = e2 Z/a2 (где Z - эффективный заряд в точке D); в то же время F9 = (e2/a2)F0. Отсюда следует, что F0 = Z. Для сил F5 и F6 получается соответственно: F5 = е2 N2x2/ (а2 + х22)3/2 = е2 N1 N2 /(x1 + х2)2 (21) F6 = е2 N1x1 / (a2 + x12)3/2 = е2 N1 N2 /(x1 + х2)2 (22) Уравнения (21) и (22) отражают равенство сил притяжения электрона F5 и F6 в точке D обоими ядрами и равенство сил отталкивания ядер в этой точке в момент наступления равновесия. Оба эти уравнения содержат три неизвестных: x1, х2 и а. Поэтому для решения системы уравнений необходимо найти третье уравнение, связывающее эти параметры. Это уравнение должно базироваться на теореме вириала, согласно которой расстояние а обратно пропорционально заряду Z или F0, a коэффициент пропорциональности легко может быть найден из соотношения этих параметров для атома водорода. Межэлектронные силы отталкивания Sn могут быть найдены из уравнения, которое будет приведено позднее. Тогда будем иметь систему из трех алгебраических уравнений с тремя неизвестными: е2 N1 nx1 /(x12 + а2) 3/2 = е2 N1 N2 /(x1 + х2)2 (23) е2 N2 nx2 /(x22 + а2) 3/2 = е2 N1 N2 /(x1 + х2)2 (24) a = R/F0 (25) где n - число связываемых электронов, R - боровский радиус (здесь принят за единицу). Соответственно, для F0 получаем: F0 = N1[(x1/a)2 + 1]-3/2 + N2[(x2/a)2+1]-3/2 - Sn (26) Естественно, что наиболее эффективный путь решения системы этих уравнений - численные методы с использованием компьютеров. В особых случаях может быть использован аналитический метод. Попробуем сделать это, когда заряды ядер одинаковы, т.е. N1 = N2. Тогда x1 = х2 = b и уравнение (19) приобретает вид: F9 = F8 + F7 - Fe = (e2/a2{2N1[(b/a)2+1]-3/2 - Sn)} (27) Для решения уравнения (27) нужно знать соотношение b/а и значение Sn. Отношение b/а может быть найдено из уравнения (24). Т.к. x1 = х2 = b, то из уравнения (24) получается: b/a = [(4n/N)2/3 - 1]-0,5 (28) Теперь подставив b/а в уравнение (26), получим: F0 = (N2/2n) [(4n/N)2/3 -1 ]3/2 - Sn Поскольку ранее было показано, что F0 = Z, то, следовательно, энергия молекулы равна энергии системы, имеющей ядро с зарядом Z + Sn и n электронов, вращающихся вокруг него по единой орбите. Когда число связывающих электронов n = 2, то энергия молекулы равна энергии гелийподобного атома с зарядом ядра Z + Sn. Теперь рассчитаем эту энергию. Энергия систем с различным зарядом ядер, рассчитанная из экспериментальных данных как сумма двух последних потенциалов ионизации каждого из элементов (для получения гелийподобного атома из исходного атома нужно удалить все электроны, кроме двух последних), расположенных в Периодической системе элементов за гелием, приведена в табл. 3. Таблица 3.
Гелийподобные атомы можно представить схемой, на которой электроны расположены по обе стороны от ядер. Согласно этой схеме, в системе действуют три силы вдоль одной оси (прямой), которые легко могут быть просуммированы. Каждый электрон находится под действием силы, равной разности притяжения и отталкивания. Как известно, электростатические силы прямо пропорциональны зарядам частиц и обратно пропорциональны квадрату расстояния между ними (закон Кулона): F = q1 q2 / R2 Вычислим все силы, действующие в гидрид-ионе. Силы отталкивания между электронами составляют 25% от сил притяжения электрона ядром. Следовательно, в присутствии второго электрона на орбите реальные силы притяжения каждого электрона ядром будут составлять лишь 75% силы притяжения электрона ядром. Мы уже знаем, как может быть рассчитана энергия содержащей один электрон системы с известным зарядом ядра (см. уравнение (9)). Энергия гелийподобных атомов может быть найдена по полученному нами уравнению: En = 2 EH(Zn - 0,25)2 (29) где EH - энергия атома водорода; Zn - заряд ядра соответствующего гелийподобного атома. Расчетные данные, приведенные в табл. 3, были получены с помощью уравнения (29). Данные для расчета энергии водородоподобных атомов (см. табл. 1) были найдены с использованием уравнения (9); экспериментальные данные представляют собой последние потенциалы ионизации для соответствующих элементов (понятно, что для получения водородоподобного атома, нужно из исходного атома удалить все электроны, кроме одного). Сравнение экспериментальных и расчетных данных, приведенных в табл. 1, показывает, что расхождения между ними не превышают 0,1%, что свидетельствует о высокой надежности экспериментов и точности уравнения (9). В случае гелийподобных атомов расхождения являются постоянным фактором и закономерно снижаются от 6,2 до 1,4 % при увеличении заряда ядра от 1 до 8. Расхождение экспериментальных и расчетных данных показано на рис.4.
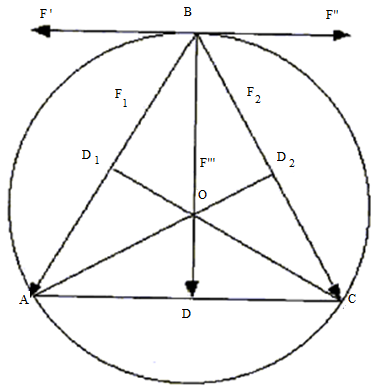
Рис. 4. Зависимость расхождения расчетных и экспериментальных значений потенциалов ионизации от заряда гелийподобных атомов. Полученная на рис.4 зависимость хорошо описывается уравнением X = (0,93 +0,0114.Z) (30) характеризующим поправку к уравнению (29), которое с учетом этой поправки примет окончательный вид: En = 2EH (Zn - 0,25)2 (0,93 +0,0114Z) (31) Действие сил отталкивания для трехэлектронной связи может быть рассчитано с использованием схемы для атома гелия. Действие этих сил схематически изображено на рис. 5, на котором электроны расположены в точках А, В и С, а ядро - в центре окружности (на рисунке не показано).
Рис. 5. Треугольник сил межэлектронного отталкивания Треугольник ABC, согласно модели, является равносторонним, и все биссектрисы одновременно будут и медианами, и высотами. На этом рисунке F' и F'' представляют собой проекцию сил отталкивания электрона в точке В от электронов в точках A (F1) и С (F2). Согласно тригонометрии, мы можем найти отрезки CD2 и ВС. CD2 = ОСcos∠D2CO. Поскольку ОС = R (радиус круга), ∠D2CO = 30°, то CD2= Rcos 30°; ВС = 2 R cos30°. Силы отталкивания электронов В и С обратно пропорциональны квадрату расстояния между ними, т.е. (ВС) = 4R2 cos2 30° = (е2 / R2) ∙ 0,5773. Общие силы отталкивания электрона в точке В от электронов в точках А и С обратно пропорциональны двум квадратам расстояния, т.е. (1/2) R2 cos2 30°. Силы F1 и F2 взаимно компенсируются, будучи равными по величине и противоположными по направлению. Поскольку треугольник DВС прямоугольный, проекция силы F1 на BD будет равна F1sin 60°, а для обеих сил (F1 и F2) 2 F1(2)sin 60°. Согласно изложенному ранее Sn = Fea2/е2 (32) где Fe - межэлектронные силы отталкивания, а - радиус окружности, на которой находится электрон; здесь а = R. Таким образом, когда три электрона находятся на орбите, объединяя атомы в молекулу, Sn= 0,5773. к разделу Заключение → |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||